药品作为一种特殊商品,必须确保其可及性,才能保障社会公众的健康福利。药品可及性,一方面涉及通过鼓励创新增加基本药品的种类和数量,另一方面涉及通过支持仿制药发展控制药品可负担的价格;但是二者之间存在一定程度的冲突,因此,需要国家层面通过制度设计来寻求二者的平衡。
2017年以来我国开始进入医药行业政策的调整期,来自国家层面的医药政策文件频发,包括SFDA于2017年5月12日发布的《关于鼓励药品医疗器械创新保护创新者权益的相关政策(征求意见稿)》,中共中央办公厅和国务院办公厅于2017年10月8日联合发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,以及国务院办公厅于2018年3月21日发布的《关于改革完善仿制药供应保障及使用政策的意见》等。
作为全球医药龙头的美国,在药品监管过程中也经历了平衡鼓励新药创新与促进仿制药尽快上市之间关系的摸索过程。并最终通过药品申报路径设计、试验数据保护制度、专利链接制度等的配合设计,对存在矛盾的各方关系进行了相对妥善的调和。
我国在进行制度设计和实施的同时,可以借鉴美国的相关经验。需要我们对美国药品上市审批制度和其相关知识产权制度配合设计机制深入了解。
美国药品报批过程中,对于505(b)(1) 新药申请, 505(b)(2) 新药申请和505(j) 仿制药申请这三种美国药品审批路径,涉及的知识产权问题各不相同,可以归结为数据保护制度和专利保护制度。
数据保护制度
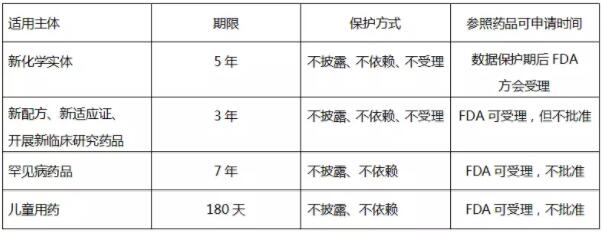
所谓数据保护制度,是药品上市后市场独占保护的一种行政手段,用于保护新药开发商自主进行药品开发的投资利益和积极性。具体指在药品上市批准过程中,申请者必须向FDA提交与药品研发相关的未披露试验数据,以证明其申请注册药品的安全性和有效性,在一定的保护期内,FDA 或者未经许可的第三方均不得依赖这些数据批准或取得相关药品的上市许可。
根据三种审批路径适用对象的差异可知,数据保护制度主要适用于505(b)(1) 新药申请和505(b)(2) 新药申请。具体的数据保护类型及保护方式,规定于美国联邦法规汇编21CFR314.108,见下表:
专利保护制度
药品申报过程中的专利保护制度,可具体为专利链接制度。所谓药品专利链接(patent linkage),是指药品上市批准与创新药品专利期满相“链接”,即药品注册申请应当考虑先前已上市药品的专利状况,从而避免可能的专利侵权。
美国联邦法规汇编中关于药品的章节21CFR 314.53 规定,505(b)(1)申请人和505(b)(2)申请人在递交新药申请时需同时提交相关专利信息,新药申请批准后,FDA会将专利信息在橘皮书上予以公布。21 CFR 314.50(i)要求,505(b)(2)申请人和505(j)申请人在递交申请时需对橘皮书中所列参比药物的相关专利逐个提交声明,并将相关不侵权声明递交NDA 所有权人/专利权人。其中,专利声明包括四种:
①橘皮书中没有相关专利,申请人应递交“第I 阶段声明”;
②相关专利已经过期,申请人应递交 “第II 阶段声明”;
③虽有专利,但申请产品将于专利期届满后上市,申请人应递交“第III 阶段声明”;
④认为专利不可执行、专利无效,或制造、使用及销售申请药品时不侵犯专利权,申请人应递交“第IV 阶段声明”。
此外,对于用途专利,若申报的药品用途未涵盖在参比药物橘皮书所列用途专利中,则仿制药商只需提交一个第Ⅷ节声明即可[1]。该声明的使用前提为FDA 批准的药品用途并没有被原研药商用途专利所穷尽,申请人可选择不侵犯专利权的多个或一个用途来申请上市,即所谓的药品标签例外。
专利链接制度的纠纷解决机制
参比药物批件持有人在收到第Ⅳ段声明之日起45 日内,可以向联邦法院提起诉讼,要求裁定相关专利有效,和/或505(b)(2)申请人和505(j)申请人侵权,并通知FDA 联邦法院已经受理有关诉讼。但如果接到通知45 天之内,参比药物批件持有人并未向法院提起诉讼请求,则经过符合条件的材料评审,FDA 便可批准产品上市。
如果参比药物批件持有人提起诉讼,依照21 U.S.C. § 355(c)规定,FDA 将给予参比药物批件持有人30 个月的时间解决专利纠纷,同时FDA会对产品继续审评,但批准会自动推延30 个月。若在此期间FDA完成审评,并确认该药品符合“安全性、有效性、质量可控性”要求,会颁发临时批准(Tentative Approval)。需要注意的是,申请人不能基于临时批准将药品上市,直至法院判定侵权不成立,或30个月延迟期结束,FDA颁布最终批准,所申请的药品才能够上市。
若在30个月延迟期内,法院判定专利侵权成立则FDA立即结束审评,药品不予批准上市。反之,FDA 继续审评,或审评通过后颁发最终产品上市批准。
如果在30 个月(或宽限期)内,专利纠纷没有结束,FDA 也将批准该药品上市。但最后如若判定侵权成立,药品厂商将面临巨额的惩罚性侵权赔偿。