近日发表于Diabetes Care杂志的一项为期26周的随机化、多中心、双盲临床试验结果结果显示,每天一次的司美鲁肽(Semaglutide)以0.3mg/d的剂量对2型糖尿病患者的降糖效果显著优于利拉鲁肽与安慰剂对照,但其消化道不良事件的发生率亦高于后两者。
司美鲁肽是FDA于去年5月批准的一种新型GLP-1受体激动剂类降糖药,通过乙酰化实现了可以每周给药一次的长效性,因此与利拉鲁肽等每天一次的GLP-1受体激动剂相比具有一定的优势,又因为其显著的降糖与减重效果而被誉为“史上最好的降糖药”。此外,原研方诺和诺德也在积极推进口服司美鲁肽的临床开发,将会使司美鲁肽的市场表现锦上添花。
本文以FDA橙皮书、Thomson Reuters Integrity报告为基础,再结合主自的专利检索,分析了司美鲁肽原研方的专利布局,从而为国内志在仿制司美鲁肽的企业提供专利风险分析的基础资料。
已上市产品的专利
(一)化合物专利
FDA橙皮书中的US8129343与US8536122同为司美鲁肽的基础化合物专利,其中国同族专利CN200680006674.6已授权,有效期截至2026年3月19日。中国化合物专利在其授权公告文本的权利要求1就保护了司美鲁肽的结构。虽然有两件中国化合物专利的分案申请(CN201310534370.9与CN201410513914.8),但均未授权,且已中上了审查进程。
(二)组合物/制剂专利
根据FDA公布的产品说明书,司美鲁肽注射液中含有丙二醇作为其辅料之一。FDA橙皮书中的US8114833保护了含有丙二醇的肽制剂,其中国同族专利CN200480034152.8已授权,有效期截至2024年11月17日。值得注意的是,诺和诺德的另一款GLP-1受体激动剂利拉鲁肽的制剂中也含有丙二醇作为其辅料之一,所以US8114833也是FDA橙皮书中收录的利拉鲁肽专利之一。
(三)给药装置专利
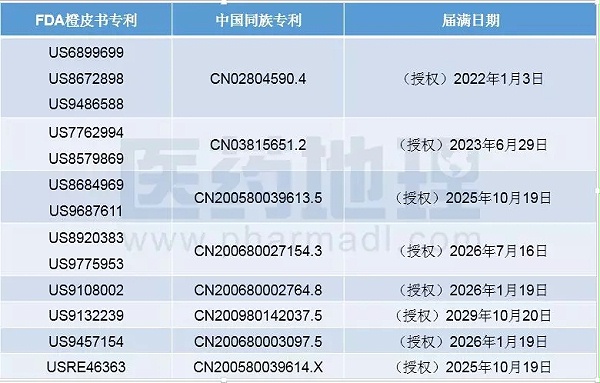
FDA橙皮书中收录的司美鲁肽的其他专利均为与其给药装置相关的专利,如下表所示。
表1 FDA橙皮书中收录的与司美鲁肽给药装置相关的专利
 其他产品专利
其他产品专利
(一)口服制剂专利
诺和诺德公司于2011年12月16日要求的中国专利CN201180060463.1于其公开文本的权利要求1要求保护“包含GLP-1激动剂和N-(8-(2-羟基苯甲酰)氨基)辛酸盐(SNAC)的用于口服给药的固体组合物”,并于权利要求11将所述的GLP-1激动剂限定为司美鲁肽。但由于C Beglinger等人在Pharmacokinetics and Pharmacodynamic Effects of Oral GLP‐1 and
PYY3‐36: A Proof‐of‐concept Study in Healthy Subjects.(Clinical Pharmacology and Therapeutics, 2008, 84(4):468~474) 一文中已经公布了采用SNAC实现GLP-1受体激动剂口服给药的技术方案,而且技术问题以及技术效果均与CN201180060463.1相同,因此,审员以最终以不满足创造性要求为理由驳回了该专利申请。虽然诺和诺德公司提出了复审请求,并申请了分案,但个人觉得挽回的余地不大。
虽然CN201180060463.1及其分案的授权前景不容乐观,但诺和诺德申请了一系列外围专利,并取得了很好的补救效果。
2013年3月15日申请的CN2013800115554.2已获得授权,该专利对包含司美鲁肽与SNAC的口服药物组合物进行了改良,具体的,公告文本的权利要求1保护的技术方案如下所示:包含第一类型颗粒和第二类型颗粒的药物组合物,其中所述第一类型颗粒包含SNAC且不含GLP‑1肽,且其中所述第二类型颗粒包含GLP‑1肽且不含SNAC,所述SNAC的释放与所述GLP‑1肽的释放同时发生,或者所述SNAC的释放比所述GLP‑1肽的释放更快,所述释放是通过使用基于美国药典35的测定(I)的溶出度试验在30分钟内、pH值1‑6.8的任一pH下进行确定的。
优先权日期为2013年5月2日的WO2014177683于其权利要求1中要求保护“包含GLP-1肽与增强子的口服固体组合物”,并于权利要求5、6将所述的增强子限定为SNAC,于权利要求8将所述的GLP-1肽限定为司美鲁肽,但该专利未进入中国。
2013年10月16日申请的CN201380054130.7于其公开说明书的权利要求1要求保护“包含GLP-1肽和至少一种脂肪酸氨基酸药物组合物”,并于权利要求2将药物组合物限定为口服药物组合物,但该专利已被视为撤回。
诺和诺德于2016年1月28日申请了CN201680007764.0,该专利尚处于实质审查阶段,其公开文本的权利要求1要求保护“固体药物组合物,其包含ⅰ)包含中链脂肪酸的盐和GLP-1激动剂的芯;和ⅱ)在pH6.0或更高,如PH6.5或更高,或pH7.0或更高时溶解的第一包衣”。
(二)其他产品专利
优先权日期为2016年12月16日WO2018109162要求保护一种含有胰岛素的药物组合物,并在权利要求13将所述药物组合物限定为“可进一步包含司美鲁肽”。
用途专利
优先权日期为2012年7月1日的WO2014005858要求保护采用长效GLP-1受体激动剂治疗2型糖尿病与肥胖症等疾病的方法,但该专利未进入中国。
优先权日期为2016年4月28日的WO2017186896要求保护“采用司美鲁肽治疗并发有心血管疾病的2型糖尿病患者的方法”,该专利尚未进入中国。
总结
司美鲁肽是继续艾塞那肽、利拉鲁肽、阿比鲁肽、度拉鲁肽与利西拉肽之后上市的第六个GLP-1受体激动剂类降糖药,因为良好的降糖与减重效果,以及每周一次的给药方案而备受青睐。而正在处于研发阶段的口服制剂如果成功上市,也将开创GLP-1受体激动剂口服给药的先河。而随着利拉鲁肽的专利到期,诺和诺德公司对司美鲁肽给予了很高的期望,自然会对其进行周密的专利布局。
根据本文的分析结果,诺和诺德公司的司美鲁肽专利布局覆盖了化合物、已上市制剂、在研的口服制剂、给药装置、用途等诸多方面,为仿制药厂家的进入构筑了有效的专利壁垒。但由于笔者精力的限制,特别是早期专利对所保护成分描述的多样性,本文的专利检索肯定会有所遗漏,还请广大读者谅解并补正。


