多年来,为了获得药品上市批准, 原研药与仿制药各方如同争霸武林盟主的各路医药江湖中人,明争暗斗一刻没有停息。2017年5月12日,国家食品药品监督管理总局(CFDA)发布了总局关于征求《关于鼓励药品医疗器械创新保护创新者权益的相关政策(征求意见稿)》意见的公告(2017年第55号),明确提出中国将建立药品专利链接制度、完善药品试验数据保护制度以及建立上市药品目录集。2017年10月8日,中共中央办公厅、国务院办公厅正式印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(简称《意见》),其中明确提出:探索建立药品专利链接制度,开展药品专利期限补偿制度试点,完善和落实药品试验数据保护制度,促进药品仿制生产。
CFDA 55号公告和两办《意见》如同在医药江湖中接连炸响了两声惊雷,一时间,医药界和IP界人士纷纷奔走相告(狂刷朋友圈),中国自己的药品专利链接制度就要来了!
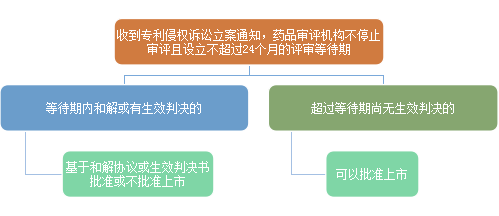
江湖险恶,危机四伏,通观全局才能笑傲江湖,不妨先概览一下 55号公告中关于专利挑战和审批等待期的主要内容:
1)专利挑战
2)审批等待期
虽然对于征求意见稿规定的具体细节业界还有不同声音,但中国版药品专利链接制度的框架已经跃然纸上。与美国的专利链接制度相类似,都是通过专利挑战环节,将仿制药注册申报一方(简称仿制药方)的上市注册申报和是否侵犯拥有专利权的在先药品注册一方(简称原研药方)的专利权判定链接在一起,博弈双方在仿制药注册审批之初就不得不短兵相接。
一时间,医药江湖风起云涌,掌握专利挑战主动权的仿制药方如何应对?
在先注册药品的授权专利是仿制药注册上市路上的天堑鸿沟。仿制药方只有打破专利壁垒,成功挑战专利才有望开疆扩土,获得生产、销售仿制药的上市批准,与原研药方瓜分中国市场份额。同时,对于首个挑战专利成功的仿制药方,还将额外得到为期一年半的数据保护期红利。面对如此巨大的利益诱惑,仿制药方自然会跃跃欲试。
身在医药江湖,如何用好发起专利挑战的主动权,仿制药方先要从哪里入手,才有可能在对原研药方的专利挑战中取胜?在药品专利链接制度实施三十多年的美国,中国仿制药企业已经有了成功案例:
浙江华海药业旗下的美国Prinston 制药公司在向美国食品和药品管理局(FDA)提交了抗抑郁药-甲磺酸帕罗西汀胶囊的仿制药上市申请之后,按照程序要求主动挑战原研药物Brisdelle的权益人美国Sebala 国际有限公司的相关专利权。当地法院于2017年6月9日作出一审判决,确定Prinston的仿制药不侵犯Sebala的专利权(US7598271),同时认定该公司的另外两件专利权(US8658663、US8946251)无效。2017年8月18日,华海药业下属Prinston提交的仿制药帕罗西汀胶囊历时3年终于获得FDA批准,成为通过成功挑战专利而在美国FDA获批首仿药。
中国药企在美国的成功案例,无疑将提升仿制药方对即将落地的中国版专利链接制度的信心和期盼。仿制药方如何提高专利挑战的胜算?不妨听听小编从IP从业人员角度的谏言:
第一步:专利预警分析
专利预警分析一般包括侵权风险排查与侵权风险评估等工作内容。专利预警分析可由仿制药方内部团队自行完成,也可委托外部知识产权法律服务专业团队完成。
知己知彼方能百战百胜。55号公告中的上市药品目录集等同于美国的上市药品“橙皮书”(未来会作为配套措施与中国版专利链接制度同步推出),作用在于列明与获准上市药物相关专利及其专利权状态。待仿制药物一旦收入该上市药品目录集,就相当于明确了仿制药方需要进行专利挑战的具体目标。由于现行上市药品数量巨大,上市药品目录集的建立与完善还需要很长一段时间。仿制药方需要在制定药品仿制研发策略时主动进行专利检索,掌握与在先注册药品相关的各项专利。
专利侵权风险排查就是摸清待仿制药物的相关专利状态,明确中国境内的待仿制药产品本身的专利/专利申请、药物衍生专利/专利申请(例如不同剂型、生产工艺方法、二次药用、中间体、药物衍生物、组合物、分案申请等)的保护状况与保护范围,查明已授权专利的保护期限及其法律状态,以及在审专利申请的保护主题和范围。对于已经提出PCT申请但是尚未进入中国的相关专利申请也要跟踪调查。简言之,需要对存在潜在专利侵权风险的目标专利/专利申请进行风险排查。
由于在仿制药方提出注册申请的准备过程中,理论上原研药方的新专利申请会陆续公开或获得授权,原研药方配合研发进展的专利申请策略也可能实时调整,不断提交新申请和/或基于在先申请提交分案申请。相应的,仿制药方针对相关药品的专利预警需要按照一定时间间隔进行多次,开展动态风险排查。
专利预警分析中的专利侵权风险评估,是对排查发现的相关专利侵权风险大小以及危害程度逐一进行评价。实务操作中,需要对存在潜在侵权风险的相关专利的权利要求逐项分析,根据《专利侵权判定指南》以及最高院《关于审理专利纠纷案件适用法律问题的若干规定》等确定被判定侵权的风险大小以及危害程度,通过专利预警分析了解仿制药的专利侵权风险。
第二步、制定策略
策略一:正面进攻
根据专利预警分析结果,如果确认仿制药方没有专利侵权风险或者风险很低,可以择机提出药品注册申请,尽快发起专利挑战。根据55号公告,理论上讲,最快在提出注册申请20日之后,仿制药方就将面对拥有专利的原研药方的专利侵权诉讼。一旦选择正面进攻,仿制药方需要在提出注册申请之前依据专利预警分析结果制定相对成熟专利挑战策略,以及提交注册申请的有利时机。
制定专利挑战策略就是依照现行《专利法》、《民事诉讼法》等法律法规,对原研药方可能提出的专利侵权诉讼选择合适的抗辩理由,提前收集相关证据,确定应对侵权诉讼的策略。对于需要挑战多项专利权的情况,还要根据不同专利权挑战的难易程度,拟定相对成熟的诉讼预案。此外,仿制药方制定专利挑战策略时还要特别注意与宣告待仿制药相关专利无效的程序与实务衔接。
相应的,注册申请的时机选择一方面取决于药品仿制工作的研发进展是否业已满足药品审批申报的各项要求,另一方面,还需要依据专利预警分析中风险评估的结果,结合拟定的专利挑战策略,包括诉讼过程中可能用到的相关证据材料的准备情况,进行适当调整。
依照55号公告,主动发起专利挑战的最大好处是一旦挑战成功,则有望赢得赋予专利挑战成功的首仿药一年半的数据保护期,这是药品审批部门授予首仿药一方的额外的市场独占权。
策略二:釜底抽薪
所谓釜底抽薪,是指对在先注册上市的药品相关专利权直接提起无效宣告请求。根据现行《专利法》,自公告授予专利权之日起,任何单位或者个人均可以请求专利复审委员会宣告该专利权无效。一旦原研药方的相关专利权被成功宣告无效,则完全排除了仿制药注册申请的侵权风险,面对仿制药的上市批准,原专利权人只能望洋兴叹。
如果专利预警分析认定发起专利挑战的成功几率较低,仿制药方需要尽早考虑是否可提起专利无效宣告请求。待成功无效掉相关专利后,再提出药品注册上市申请。
发起无效宣告请求的时机一般需要在仿制药提交注册上市申请前2-3年甚至更早的时间。这是因为,当前无效宣告请求在专利复审委员会的审理周期按照规定一般为6个月审结,复审委做出决定后3个月内当事人没有起诉则决定生效。如当事人不服复审委的决定可提起专利行政诉讼。根据行政诉讼法相关规定,行政诉讼案件当事人均为中国人的情况下,据统计,一审的审理期限通常为9-12个月左右(3个月+6个月),不服一审判决提出上诉的,二审审理还需要另外大约3-6个月时间(15天+3个月)。对于向最高院提出申诉并受理的特殊案件,最高院再审也需要约一年或更长时间(6个月+6个月或者6个月+3个月)。专利行政诉讼程序无疑会进一步加长专利确权的审理周期。若行政诉讼案件属于一方或双方当事人为外国人的涉外案件,一审二审的时间还将更长。但是为了降低上市后的专利侵权风险,缩短药品注册申请审批的等待期,利用无效宣告请求途径将原研药方相关专利成功无效,仍然不失为仿制药方的合理选择。
必须强调的是,这种釜底抽薪战术对于仿制药方而言如同双刃剑,有利有弊。有利的是无效宣告请求可以在相关专利获得授权之后、药品注册申请提出之前的任何时间提出,甚至可以在药品仿制工作开展之前启动。实践中,如果能够在制定药品仿制策略的最初就发起无效宣告请求,可以帮助仿制药方对潜在的专利侵权风险做全面评估,合理制定药品仿制策略,规避药品侵权风险。不利一面是,一旦相关专利被无效,所有同一品种的仿制药厂都可以“搭便车”,挤占市场份额,瓜分打破专利垄断带来的市场利润。更重要的是,首仿药不再获得成功挑战专利的相应奖励--数据保护期,甚至难以收回发起专利无效宣告请求及后续行政诉讼程序等前期投入。
策略三:合纵连横
合纵连横本意是指战国时期,部分相对弱小的国家对抗强大的秦国所采取的外交与军事策略。为了确保商业利益最大化,作为博弈双方的仿制药方与原研药方彼此之间也有根据实际情况选择合纵连横的现实需要。仿制药方不妨在发起专利无效宣告请求或者提起专利挑战之前,通过有效的商务谈判促成原研药方与自己合作,化解专利侵权风险,共同瓜分首仿药的市场独占权。
例如,拥有药品上市许可持有人资格的大连美罗药业主要从事国家基本药物、国际仿制药和生物医药的研发制造。日前,拥有治疗高胆固醇血症和混合型血脂异常症原研药“可定”的阿斯利康公司与美罗药业签定合作协议,由阿斯利康接受美罗药业的委托生产包括原研药“可定”在内的仿制药,协助美罗药业完成四个品种仿制药的注册申报和仿制药一致性评价。对于仿制药方而言,与原研药方合作相当于变相得到许可,不仅缩短了上市审批时间,而且仿制药厂和原研药厂双方得利,彼此分享数据保护期红利,与原研药厂联袂独霸江湖,在药品定价权上掌握主动。
策略四:反客为主
除了前面三种策略,仿制药方还可以反客为主,通过专利贸易等方式获得原研药方的专利权或专利许可,化解专利侵权风险。实际上,自2015年7月开始医药企业的药物临床实验数据自查以来,CFDA的药品批文库中已有近1.6万件药品批文被撤销或放弃。仿制药企要么转向自主研发,要么依靠专利交易才能顺利获得新药注册。
早在2002年12月,丽珠集团以独占许可方式从韩国一洋制药株式会社购买艾普拉唑专利许可,开启了我国药企与外国企业进行专利许可贸易继而在国内进行开发的先河。2007年12月,丽珠集团的艾普拉唑获得CFDA颁发的国家一类新药证书和生产批件。丽珠集团在艾普拉唑研发过程中陆续申请了中国专利24件,保护范围覆盖化合物、盐、晶型、制备工艺和剂型等。与此同时,利用PCT途径提交了多件海外专利申请,目前已在美国、日本、欧洲、澳大利亚、加拿大等国家和地区获得授权。显然,部分先行一步的中国药企已经尝到了药物创新与专利许可贸易的甜头。越来越多的仿制药方依靠“专利许可贸易+新药研发”方式完成向原研药方的转型也是大势所趋。
中国版药品专利链接制度出台的目的就是为了鼓励医药创新,加速仿制药品的上市。同时,也把多年来以仿制药为主的相当一批中国医药企业逼到了不得不破釜沉舟、背水一战的地步。生死关头,如果不能成功挑战专利拿到仿制药上市批准就要关门大吉。可以预见随着药品专利链接制度的渐行渐近,除了引发仿制药方与原研药方之间一大波专利侵权诉讼和专利无效宣告案件,相信也会看到越来越多的专利交易和自主研发的消息。面对中国医药江湖的风起云涌,仿制药方如何发起绝地反击,让我们拭目以待。